研究内容
Sake yeast for light-bodied sake
–Breeding and analysis of the yeast, and commercial scale sake brewing–
December 28, 2020

We have successfully brewed light-bodied Japanese sake with reduced levels of succinate, which would otherwise confer a sour taste, by using a proline-overproducing sake yeast strain. γ-Glutamyl kinase (GK), a key enzyme that regulates proline synthesis, was found to contain a single amino acid substitution (Q79H) in the bred yeast. This mutated enzyme was less sensitive to feedback inhibition than the wild-type enzyme. Metabolic analysis of the yeast elucidated the underlying mechanism for the observed decrease in the level of succinate.
Due to changes in consumer preferences, there is an increasing demand for Japanese sake such as ginjo-shu (premium sake), daiginjo-shu (super premium sake) and light-bodied sake. However, to maintain the desired balance of taste these sakes must have a low level of acidity as measured by an index of sourness. The sourness arises from the presence of organic acids in the sake. Technology to suppress the organic acid content includes brewing sake using specially bred yeast strains. The main organic acids produced by yeast during the brewing of sake include malate and succinate, which are mostly derived from the tricarboxylic acid (TCA) cycle. However, various amino acids are also synthesized from metabolites produced in the TCA cycle. Thus, producing specific amino acids at a high level would be expected to change the balance of malate and succinate, resulting in a decrease in organic acid content.
In the present study, we focused on a high-level proline-producing yeast strain. The amino acid proline is synthesized from glutamate that is derived from 2-oxoglutarate, a key intermediate in the TCA cycle. The biosynthesis of proline is regulated through the activity of GK, which is subject to feedback inhibition by proline. Therefore, we analyzed the properties of GK with the aim of elucidating a mechanism for the low level production of organic acids during the brewing of sake. The study was supported by the "Research Program on Development of Innovative Technology" of the National Agriculture and Food Research Organization (NARO), which is headed by Professor Hiroshi Takagi at the Division of Biological Science, Nara Institute of Science and Technology (NAIST).
Isolation of AZC-resistant strains
Some yeast strains that are resistant to the proline toxic analog azetidine-2-carboxylic acid (AZC) produce elevated levels of proline when GK is released from feedback inhibition by proline. We obtained 18 AZC-resistant strains derived from K-9 sake yeast as the parent strain. In small-scale brewing tests, most of the AZC-resistant strains displayed a low acidity compared to the parent strain. We also found that the mutant strains produced higher-levels of proline and lower-levels succinate. Among the resistant strains obtained in this study we selected one, named K-9-AZC, which had low acidity and good fermentation characteristics.
PRO1 gene sequence and γ-glutamyl kinase activity of the AZC-resistant strain
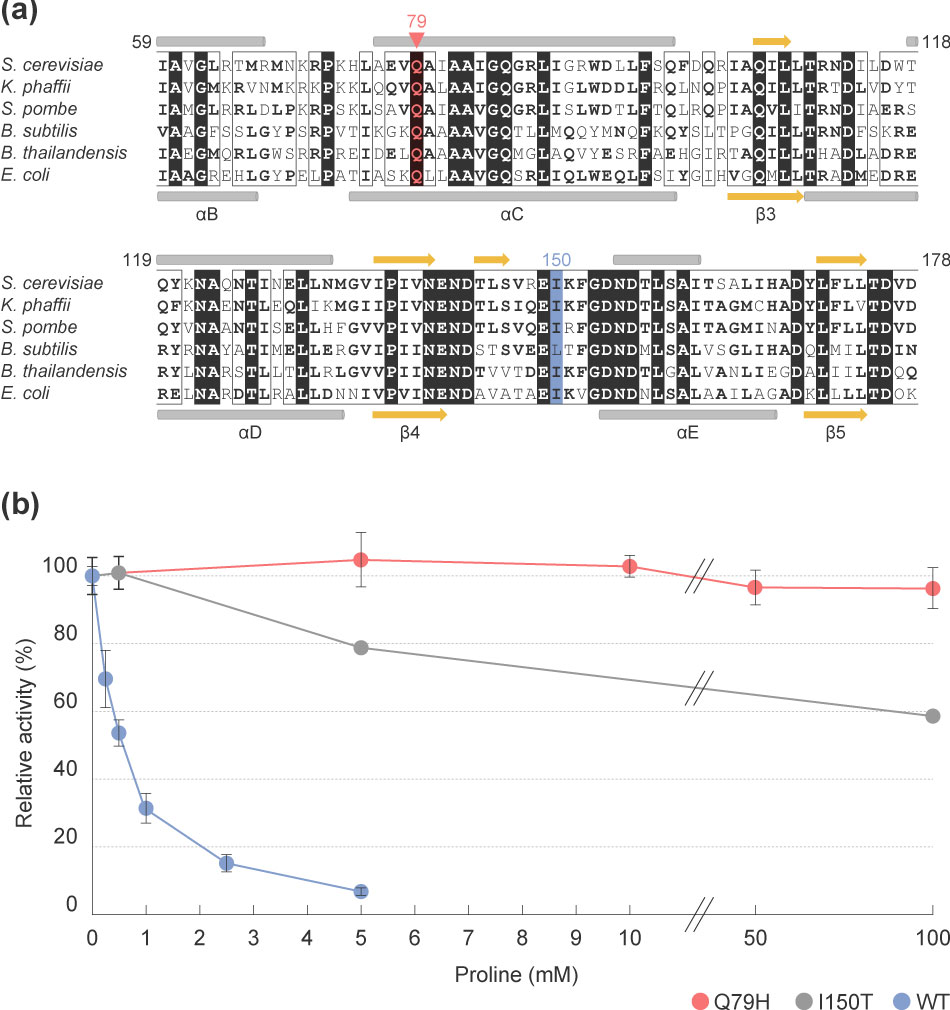
It is known that many AZC-resistant yeast strains producing elevated levels of proline carry a mutation in the PRO1 gene encoding GK, which makes the enzyme less susceptible to feedback inhibition by proline. When the nucleotide sequence of the PRO1 gene of K-9-AZC was determined, we identified a novel mutation in the gene i.e. Q79H variant of GK (where a glutamine is replaced by histidine as the 79th residue from the amino terminus). A sequence alignment of GK from other microorganisms shows Q79 to be highly conserved. Indeed, the amino acid substitution Q79H has never previously been reported (Figure a).
Next, we purified this variant GK (Q79H) and measured its enzyme activity. The activity of the wild-type GK (WT) was dramatically decreased with increasing concentrations of proline, whereas the Q79H variant displayed no such inhibition even in the presence of a high concentration of proline (100 mM). Moreover, the degree of desensitization of the Q79H variant to proline is much greater than that of the known variant GK (I150T). These results suggest that the Q79H variant of GK overproduces proline, resulting in production of a low acidity sake.
Comparison of the organic acid composition between the AZC-resistant strain and its parent strain
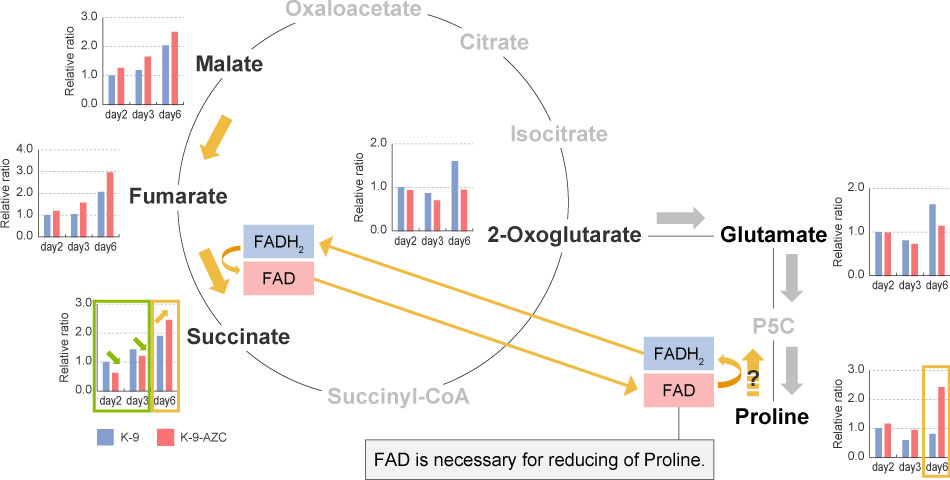
We comprehensively analyzed metabolites to further examine the mechanism for brewing sake with low acidity. Thus, the major organic acids and amino acids in the yeast cells during fermentation were analyzed. Our results showed that proline was overproduced from 2-oxoglutarate and glutamate, because the AZC-resistant strains had lower levels of these metabolites. However, the increased levels of succinate from day 6 was inconsistent with "low succinate production".
This result might be due to changes in the metabolism of the TCA cycle between the early stage of fermentation (Days 2-3) and the later stage (Day 6), which is associated with excessive accumulation of proline. The TCA cycle metabolism works in the oxidative pathway on Days 2-3 (clockwise in the Figure) and 2-oxoglutarate is used for proline synthesis, resulting in a low productivity of succinate. Nonetheless, on Day 6, an excess amount of proline exists. During this period, conversion of proline into glutamate occurs, followed by the conversion of fumarate into succinate for supplying the required FAD. Because these two reactions occur within the mitochondria, it is hypothesized that succinate accumulates in the mitochondria and will not be released from the cell.
This hypothesis might explain the increased intracellular levels of succinate.
Brewing tests using AZC-resistant strains
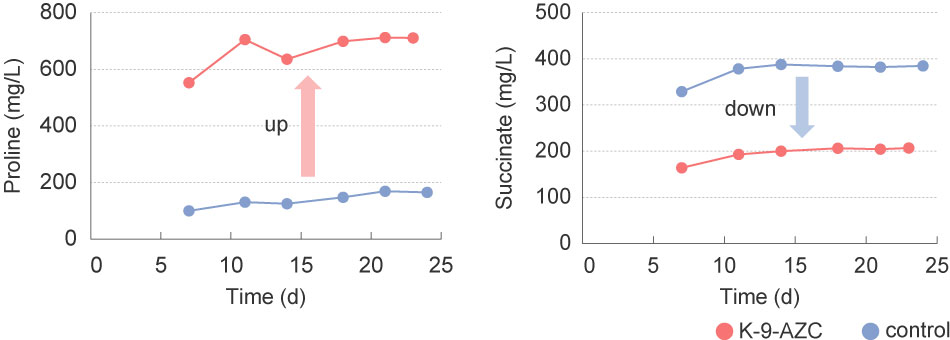
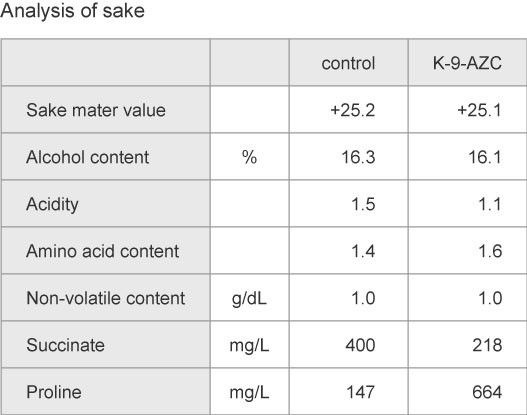
The K-9-AZC and K-9 derivative yeast (control strain) were also used for sake brewing on a commercial scale, and the final products were compared. After sake fermentation, it was shown that the sake meter value, alcohol, and amino acid contents were very similar, although the acidity was reduced to about 70% compared with the control strain. K-9-AZC produced a higher-level of proline and a lower-level of succinate compared to the control strain during small scale sake brewing. In addition, a sensory test revealed that the sourness of sake brewed with K-9-AZC was suppressed. Thus, we successfully brewed sake with lower acidity in terms of both the analysis values and sensory evaluation.
Conclusions
A proline overproducing strain was isolated from AZC-resistant strains, which facilitated the brewing of sake with reduced levels of succinate that would otherwise impart a sour taste in the final product. Analyses of the high-level-proline-producing strain identified a mutation in the gene encoding GK, which regulates proline synthesis. The mutation eliminated feedback inhibition of GK activity by proline, resulting in a lower succinate content in the sake.
In a future study, we aim to develop various types of sake to add value to our products by breeding yeasts that produce high-levels of amino acids with flavor and functionality.
*Figures in the text are quoted and partially revised from the references given below.
References
- 1) Atsushi Kotaka, Yukihiro Nakamura, Hirokazu Kasai, Yoshiaki Watanabe, Maiko Morimoto-Sakakibara, Kengo Matsumura, and Yoji Hata : Journal of the Brewing Society of Japan, 114(12) p787-794 (2019)
- 2) Naoyuki Murakami, Atsushi Kotaka, Shota Isogai, Keiko Ashida, Akira Nishimura, Kengo Matsumura, Yoji Hata, Hiroki Ishida, and Hiroshi Takagi : Journal of Industrial Microbiology and Biotechnology, 47, 715–723 (2020)
URL: https://rdcu.be/b54bd
Presentations
- 1) “ Breeding of proline accumulating Sake yeast and functional analysis of a novel glutamyl kinase variant found in the breeding strain”
○Shota Isogai, Yoichi Toyokawa, Atsushi Kotaka, Yurie Takasaki, Keiko Ashida, Naoyuki Murakami, Kengo Matsumura, Akira Nishimura, Yoji Hata, Hiroki Ishida, and Hiroshi Takagi
The 2020 Annual Meeting of Japan Society for Bioscience, Biotechnology, and Agrochemistry (2020) - 2) “Development of amino acid-analogue-resistant sake yeast for commercial scale sake brewing”
○Atsushi Kotaka, Naoyuki Murakami, Kengo Matsumura, Yoji Hata, Hiroshi Takagi, and Hiroki Ishida
The 35th International Specialized Symposium on Yeasts (ISSY35) (2019)
<訳>
「淡麗辛口用清酒酵母の育種と解析、実醸醸造」

プロリン高生産の酵母を育種することで、酸味であるコハク酸が少ない淡麗辛口の日本酒を醸造することができました。また育種した酵母のγ-グルタミルキナーゼ(プロリン合成を制御する鍵酵素)を調べたところ、酵素の遺伝子にアミノ酸置換を伴う変異が導入され、従来の酵母よりもフィードバック阻害を受けにくいことが明らかとなりました。また、酵母の代謝解析を行うことにより、コハク酸が低減するメカニズムの解明に取り組みました。
消費者の嗜好の変化から、吟醸酒・大吟醸酒や、淡麗辛口などの日本酒の需要が増加しつつあります。しかしながら、これらの日本酒は香味のバランスを保つために、酸味の指標となる酸度(日本酒においては、ほとんどが有機酸)が低いことが求められています。
この有機酸含量を抑える方法として、有機酸低生産の酵母を用いて日本酒を醸造する方法が挙げられます。日本酒において、酵母により生成される主要な有機酸はリンゴ酸やコハク酸であり、これらは主にTCA回路を経由して生成されます。他方、このTCA回路の代謝物からは複数のアミノ酸も合成されるため、特定のアミノ酸を高生産させれば、リンゴ酸やコハク酸のバランスも変化し、その結果として有機酸含量が低下することが予想されます。
そこで本研究では、アミノ酸の一種であるプロリンを高生産する酵母に着目しました。プロリンは、TCA回路の代謝物である2-オキソグルタル酸からグルタミン酸を介して合成されますが、γ-グルタミルキナーゼ(Pro1)の活性がプロリンによるフィードバック阻害を受けることで合成量が調節されています。そこで、Pro1の機能や代謝産物の解析を行い、有機酸低生産となるメカニズムについても検討を行いました。なお、本研究は奈良先端科学技術大学院大学バイオサイエンス領域の高木博史教授が研究統括者を務める農研機構生研支援センター「イノベーション創出強化研究推進事業」の支援を受けて実施したものです。
AZC耐性株の取得
プロリンの毒性アナログであるアゼチジン-2-カルボン酸(AZC)に耐性を示す株の中には、Pro1のフィードバック阻害が解除されることでプロリンを高生産する株が存在します。そこで、清酒酵母のK-9を親株として、AZC耐性株を取得したところ、18株得られました。小スケールでの醸造試験を行ったところ、親株と比較してほとんどの耐性株は酸度が低くなっていました。変異株はプロリン濃度が高いただけでなく、コハク酸濃度が低いことがわかりました。得られた耐性株の中で、酸度が低く発酵性もよい株を、K-9-AZCと名づけました。
AZC耐性株のPRO1遺伝子配列とγ-グルタミルキナーゼ活性
プロリンを高生産するAZC耐性株の多くは、γ-グルタミルキナーゼPro1をコードするPRO1遺伝子に変異が導入され、γ-グルタミルキナーゼの活性がプロリンによるフィードバック阻害を受けにくくなることが知られています。そこで、K-9-AZCのPRO1遺伝子の塩基配列を調べたところ、アミノ末端から79番目のグルタミンがヒスチジンに置換している変異型酵素であることが分かりました。この79番目のアミノ酸残基は、他の微生物のγ-グルタミルキナーゼでも高く保存されており、今回見出したアミノ酸置換(G79H)はこれまで報告されていない新規なものでした(図a)。
次に、変異型γ-グルタミルキナーゼ(Q79H)を精製し、酵素活性を測定したところ、興味深いことにプロリンによるフィードバック阻害をほとんど受けないことが判明しました。野生型(WT)と既知の変異型γ-グルタミルキナーゼ(I150T)を比較したところ、プロリン濃度が高くなるに伴って、野生型(WT)は活性が著しく低下するのに対し、今回得られた変異型(Q79H)は高濃度(100 mM)のプロリンが存在しても全く阻害されないことが明らかとなりました。この結果から、変異型γ-グルタミルキナーゼ(Q79H)により、プロリンが高生産され、その結果として酸味の低い日本酒が醸造されたことが示唆されました。

AZC耐性株と親株との有機酸組成の比較
酸味の低い日本酒が醸造されるメカニズムをより詳細に解析するため、代謝物の網羅的解析を行いました。発酵途中の酵母細胞内に含まれる主要な有機酸とアミノ酸を測定したところ、AZC耐性株は、2-オキソグルタル酸とグルタミン酸の含量が少ないことから、これらを利用してプロリンの合成量が増加していることが分かりました。一方で、コハク酸は6日目から増加することから、「コハク酸低生産」とは一致しない結果になりました。
この結果については、初期の2-3日目と後期の6日目ではTCA回路の代謝に変化が起きたこと、およびプロリンが過剰に蓄積したことなどが原因であると推察しています。2-3日目では酸化的経路でTCA回路の代謝が動き(図中・時計回り)、2-オキソグルタル酸からプロリン合成に向かうため、結果的にコハク酸の生産性が低下します。それに対し、6日目には過剰量のプロリンが存在する状態になり、プロリンからグルタミン酸に変換される反応が進行すること、その時に使われるFADを供給するためにフマル酸からコハク酸に変換する反応も進んだというものです。この2つの反応は、ミトコンドリア内で起きているため、コハク酸はミトコンドリアに蓄積され、細胞外には排出されないという仮説を立てました。この仮説であれば、細胞内のみでコハク酸が増加することを説明できます。

AZC耐性株を用いた醸造試験
AZC耐性株K-9-AZCと、K-9系酵母(対照株)を用いて実地醸造試験を行いました。発酵終了後の日本酒を分析したところ、日本酒度、アルコール分、アミノ酸度はほぼ同等であったのに対し、酸度は対象株の7割程度に低減していました。小スケール試験と同様、K-9-AZCではプロリン濃度が高く、コハク酸濃度が低くなっていました。また、対象株の日本酒の方が「酸味が高い」とのコメントが多く、K-9-AZCを用いた日本酒は酸味が抑えられていることが、官能評価でも明らかとなりました。このように、分析値・官能評価ともに、酸味が低減した日本酒を醸造することができました。


まとめ
以上をまとめますと、AZC耐性株の中からプロリン高生産株を取得することで、酸味であるコハク酸が少ない日本酒を醸造することができました。また、プロリン高生産株では、プロリン合成を制御するγ-グルタミルキナーゼの遺伝子に変異が導入され、プロリンによるフィードバック阻害が解除されていたこと、そして代謝解析からコハク酸含量が増加しない仮説を立てることができました。
今後はこれらの知見を活かして、酵母に呈味性や機能性を有するアミノ酸を高生産させるなどの育種を行い、様々なタイプの日本酒を開発し、商品の高付価値化を行っていきます。
*本文中の図は、下記引用文献から引用および一部改訂をしています。
引用文献
- 1) 小高敦史、中村幸宏、葛西寛一、渡邊賢明、森本(榊原)舞子、松村憲吾、秦洋二:日本醸造協会誌, 114(12) p787-794 (2019)
- 2) 村上直之、小髙敦史、磯貝章太、蘆田佳子、西村明、松村憲吾、秦洋二、石田博樹、高木博史:Journal of Industrial Microbiology and Biotechnology, 47, 715–723 (2020)
URL:https://rdcu.be/b54bd
学会発表
- 1)「清酒酵母におけるプロリン高生産株の育種と新規なγ-グルタミルキナーゼ変異体の機能解析」
○磯貝章太、豊川洋一、小高敦史、高崎友里恵、蘆田佳子、村上直之、松村憲吾、西村明、秦洋二、石田博樹、高木博史
日本農芸化学会2020年度大会(2020) - 2)「Development of amino acid-analogue-resistant sake yeast for commercial scale sake brewing」
○小高敦史、村上直之、松村憲吾、秦洋二、高木博史、石田博樹
The 35th International Specialized Symposium on Yeasts (ISSY35) (2019)
(掲載日:2020年12月28日)








